Article de Lamia Moubakir (IGE 2019)
Bactéries hyper résistantes, féminisation de poissons mâles, espèces en danger, ces phénomènes alarmants ont pu être associés à la présence de résidus médicamenteux dans nos eaux. Principes actifs et métabolites peuvent en effet se retrouver dans l’environnement, dû au large développement de l’usage des médicaments au niveau mondial.
Médicaments administrés aux humains et aux animaux, se retrouvent par différents biais dans l’environnement et l’on peut se poser la question de l’impact réel qui en découle.
Les principes actifs sont conçus pour engendrer une réponse de l’organisme vivant à de faibles doses, ce qui signifie que son effet sur l’environnement peut survenir à de faibles concentrations, d’où la complexité du problème. Les quantités détectées restent faibles, mais n’excluent pas des effets potentiels sur la santé humaine et sur les écosystèmes aquatiques.
Ces effets sont évalués pour toute entrée sur le marché de nouvelles substances pharmaceutiques (directive européenne 2001/83/EC), sur toute la durée de vie du médicament, de sa production à son élimination après utilisation. C’est l’industrie pharmaceutique qui conduit cette analyse (Environmental Risk Assessment).
La présence de résidus médicamenteux dans les eaux représente-elle un réel danger pour la santé et pour l’environnement ?
DES TRACES AUX MULTIPLES SOURCES
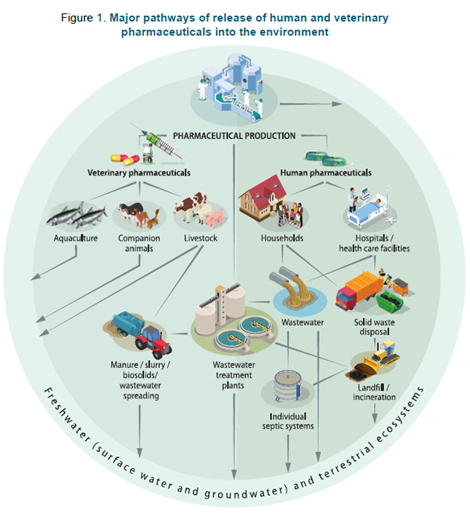
D’où viennent donc les traces de médicaments détectées dans les eaux ?
La production de médicaments, leur usage et leur élimination, ont pour conséquence leur présence dans l’environnement. Médicaments non utilisés et jetés, médicaments ou métabolites rejetés par l’organisme, peuvent se retrouver dans les eaux usées ou dans les sols.
Les principales sources de résidus dans les eaux sont diverses :
- L’agriculture (médicaments administrés aux animaux pour soigner, par prévention ou encore pour favoriser leur croissance).
- Les centres de traitement des eaux usées, qui ne sont habituellement pas conçus pour l’élimination des substances actives pharmaceutiques (pouvant être présentes dans les excrétas humains).
- L’aquaculture (médicaments administrés aux espèces aquatiques d’élevage).
- Les centres d’enfouissement des déchets, qui contiennent des résidus de médicaments pouvant se diffuser dans les sols (déchets domestiques, d’hôpitaux, etc).
- Les laboratoires pharmaceutiques (formulation et production).
Les concentrations généralement détectées sont faibles, de l’ordre du ng/L jusqu’à quelques µg/L. Des quantités élevées ont toutefois été détectées dans les effluents de certains sites industriels en Inde, Chine, Etats-Unis, Corée et Israël, de l’ordre du mg/L.
En France, on a par exemple mesuré dans le cas de l’aspirine, des concentrations de 1 ng/L dans les eaux de consommation et 10 à 100 ng/L dans les eaux superficielles.
DES RISQUES POUR LA SANTÉ HUMAINE
Des analyses ont été effectuées dans l’eau potable en ce qui concerne les résidus de médicaments. Les quantités retrouvées sont si faibles que le risque pour la santé est jugé quasi inexistant. Les concentrations retrouvées sont en effet bien inférieures aux doses thérapeutiques minimales (souvent plus de 1000 fois plus faibles).
Dans l’exemple de l’aspirine, largement consommé en France, c’est dans un volume total de 500 000 m3 d’eau potable qu’équivaut un comprimé de 500 mg.
Un problème se pose néanmoins et constitue un risque de santé majeur au niveau mondial. Il s’agit de la résistance aux antibiotiques, qui touche désormais toutes les régions du monde. Ce phénomène est lié à différentes causes, dont la présence à faibles doses d’antibiotiques dans l’environnement. On en retrouve dans les eaux usées et dans les milieux marins, venant par exemple de l’usage humain, de l’agriculture ou de l’aquaculture.
Certaines bactéries courantes sont, de façon permanente, en présence d’antibiotiques, à faibles doses, et développent ainsi une résistance face à ces antibiotiques. Ce phénomène apparaît par mutation ou acquisition d’un gène de résistance à un ou plusieurs antibiotique(s). L’acquisition d’un gène de résistance est le plus fréquent.
Les antibiotiques sont utilisés de manière excessive voire abusive chez les animaux et les humains dans le monde et leur mauvaise utilisation participe également à ce phénomène d’antibiorésistance. Dans l’agriculture, ils sont administrés pour soigner, prévenir une maladie ou encore comme facteur de croissance. Chez les êtres humains, ils sont parfois prescrits alors que ce n’est pas nécessaire, voire dans certains pays, ils sont délivrés sans ordonnance.
Une utilisation non responsable est également largement relevée, avec par exemple des antibiotiques jetés dans les ordures ménagères, des traitements arrêtés en cours de route ou prolongés en automédication, une mauvaise hygiène de vie pour lutter contre l’infection bactérienne, etc.
Des infections telles que la tuberculose, la pneumonie ou encore la gonorrhée, deviennent particulièrement résistantes aux traitements antibiotiques classiques, ce qui les rend plus difficiles à soigner. L’etude Burden de l’agence Santé Publique France indique que 12 500 personnes par an décèdent en France à la suite d’une infection liée à des bactéries multirésistantes.
Des programmes de lutte contre la résistance aux antimicrobiens, dont les antibiotiques font partie, ont été lancés et tentent d’enrayer le problème et trouver des alternatives efficaces.
DES EFFETS SUR LA FAUNE MARINE
Des phénomènes singuliers ont été observés dans la faune marine, comme par exemple la féminisation de certains poissons mâles (par exemple le poisson d’eau douce Vairon), la réduction considérable de la population de certaines espèces aquatiques ou bien des changements de comportements notables chez d’autres.
La présence d’hormones tels que les œstrogènes dans les eaux semble induire une démasculinisation de poissons mâles chez certaines espèces (ex : Vairon), ce qui altère leur reproduction. Sur le long terme, cela pourrait entraîner une diminution de la population, l’espèce ne se reproduisant que peu. Les effets sont avérés même pour de très faibles doses et ont été observées pour des concentrations d’exposition de 3 ng/L.
Également, des antidépresseurs dans les eaux seraient à l’origine d’un changement de comportement chez d’autres espèces, devenant plus promptes à la prise de risques et s’exposant davantage à de potentiels prédateurs.
Certaines molécules sont également très toxiques pour des espèces aquatiques, dont des populations ont drastiquement diminué, et qui s’en trouverait grandement menacées.
Toutefois, il faut bien noter que les molécules responsables de ces effets néfastes peuvent également venir d’autres sources non médicamenteuses, comme par exemple les pesticides utilisés dans l’agriculture. C’est donc l’addition de différents composés (principes actifs, métabolites, résidus de pesticides, produits chimiques, etc) qui serait en cause et responsable de l’ « effet cocktail », résultant d’une exposition à plusieurs substances simultanément. Ces dernières n’ayant pas nécessairement d’effet individuellement, c’est leur interaction qui peut entraîner des effets néfastes sur l’organisme récepteur.
MISE EN PLACE DE SOLUTIONS ET DE TRAITEMENTS
Que faire pour enrayer le problème ?
Les industries pharmaceutiques doivent analyser l’impact environnemental de leurs produits avant toute nouvelle mise sur le marché, de la production à l’élimination (Environmental Risk Assessment). Néanmoins, un impact jugé négatif ne pourra empêcher l’entrée du produit dans le commerce et n’est donc qu’informatif à ce jour.
Une méthode est délivrée par l’agence européenne des médicaments, et certaines entreprises pharmaceutiques vont au-delà de la directive actuelle et conduisent une analyse sur leurs produits déjà commercialisés. C’est le cas par exemple de Sanofi, qui a une démarche anticipative sur la gestion de ses principes actifs et sur les potentiels résidus de médicaments se retrouvant dans les eaux rejetées dans l’environnement.
Les stations de traitement des eaux usées n’agissent généralement pas sur les résidus de médicaments, qui se retrouvent alors dans les eaux de sortie et donc dans l’environnement. Un traitement plus efficace prenant en compte ces principes actifs et leurs métabolites serait à mettre en place mais requiert potentiellement de gros investissements.
Des stations d’épuration (STEP) existent déjà sur certains sites pharmaceutiques pour réduire la concentration de certains composants utilisés pour la production de médicaments. Certains paramètres sont classiquement analysés, notamment des produits chimiques utilisés ou résultants de la production de principes actifs,il serait désormais intéressant de rendre systématique un suivi des résidus médicamenteux dans les eaux de sorties.
Des programmes de lutte contre l’antibioresistance sont aujourd’hui en place et de nombreuses organisations sont impliquées (chercheurs, industries pharmaceutiques, etc). Des bonnes pratiques sont également diffusées chaque année pour lutter contre les infections, le mauvais usage restant une des causes principales de ce phénomène.
On peut noter par ailleurs différents programmes de reprise de médicaments usés dans les pharmacies. En France, l’association Cyclamed est engagée dans cette démarche en collectant et valorisant les Médicaments Non Utilisés (MNU), notamment dans un but de valorisation énergétique (chaleur et électricité).
L’effet des activités humaines sur l’environnement n’est plus à prouver et l’impact de la production et de la consommation de médicaments n’est pas en reste. L’effort de la part des industries pharmaceutiques ainsi que des utilisateurs de médicaments doit continuer et se consolider, il est en effet nécessaire pour limiter l’impact sur l’environnement et potentiellement sur la santé. Les écosystèmes aquatiques doivent être préservés ainsi que la qualité des eaux destinées à la consommation, au risque de produire des effets néfastes irréversibles.
–
Glossaire
Métabolite : Composé stable issu de la transformation biochimique d’une molécule initiale par le métabolisme.
–
Sources
www.ecotoxicologie.fr/medicaments.php
Pharmacology beyond the patient – The environmental risk of human drugs, August 2019, Lina Gunnarsson Jason R.Snape Bas Verbruggen Stewart F.Owen Erik Kristiansson Luigi Margiotta-Casaluci Tobias Österlund Kathryn Hutchinson Dean Leverett Becky Marks Charles R.Tyler
https://www.who.int/water_sanitation_health/emerging/info_sheet_pharmaceuticals/fr/
https://www.who.int/fr/news-room/fact-sheets/detail/résistance-aux-antibiotiques
https://www.partagedeseaux.info/Traitement-des-eaux-usees-et-resistance-aux-antibiotiques
https://www.pasteur.fr/fr/centre-medical/fiches-maladies/resistance-aux-antibiotiques
Guidelines on the environmental risk assessment of medicinal product for human use, European Medicines Agency, 15 novembre 2018
Pharmaceuticals in the environment Factsheet 2018, Sanofi, on www.sanofi.com

